L’ANSM définit qu’un médicament biosimilaire est un médicament biologique, lui-même défini comme “une substance produite à partir d’une cellule ou d’un organisme vivant ou dérivée de ceux-ci”. Ces médicaments sont issus de la biotechnologie, leur production est alors “complexe car elle s’appuie sur des systèmes cellulaires ou des organismes vivants”1. On retrouve différentes grandes catégories de médicaments biosimilaires : les anticorps monoclonaux, les facteurs de croissance, les vaccins et l’insuline.
Les médicaments biologiques requièrent des compétences de génie génétique et de biologie cellulaire qui permettent d’éviter le recours à des molécules naturelles biologiques, extraites directement d’organismes vivants (comme l’hormone de croissance issue de l’hypophyse bovine) et qui peuvent transmettre des agents pathogènes (comme le prion pour l’hormone de croissance).
Des critères de qualité biotechnologique sont exigés par l’agence européenne du médicament (EMA : European Medicines Agency) afin de réguler et de surveiller la production des médicaments biosimilaires en toute sécurité1. L’obtention de ces protéines complexes se fait à partir de culture cellulaire, la multiplication cellulaire est amplifiée grâce à un milieu de culture favorable et contrôlé, puis la protéine cible est récoltée par filtration et purification.
Il ne s’agit pas d’organismes vivants modifiés mais de substances actives complexes synthétisées de manière biologique (comme les insulines de synthèse). Le processus de fabrication de ces molécules suit les guidelines établies par l’EMA et doivent être respectées dans le cadre d’une demande d’autorisation de mise sur le marché. Par ailleurs, chaque laboratoire met en place un système de surveillance des effets indésirables, afin de suivre et d’enregistrer l’ensemble des problèmes de sécurité liés à l’usage d’un de ses médicaments biosimilaires1.
Les médicaments biosimilaires sont issus d’une source biologique et sont développés par génie génétique en comparaison à un médicament biologique de référence déjà commercialisé et dont le brevet est tombé dans le domaine public. Un médicament biosimilaire est avant tout un médicament biologique1, ce n’est donc pas comme un médicament générique produit par synthèse chimique.
L’AMM d’un médicament biosimilaire est délivrée sur la base d’une équivalence des résultats thérapeutiques sur le plan chimique, clinique et biologique, et pas uniquement sur le plan chimique et sur la base de la bioéquivalence comme pour les médicaments génériques.
La démonstration de la similarité d’un médicament biosimilaire par raport à un médicament de référence nécessite des essais précliniques et cliniques, notamment en comparant la pharmacocinétique et en évaluant le rapport efficacité-tolérance avec le médicament biologique de référence.
Un médicament générique est défini d’après l’article L5121-1 du code de la santé publique comme étant un médicament ayant la même composition qualitative et quantitative en principe actif, la même forme pharmaceutique qu’une spécialité de référence, et dont la bioéquivalence avec la spécialité de référence est démontrée par des études de biodisponibilité appropriées.
Les médicaments génériques sont soumis aux mêmes exigences que le “médicament” princeps en termes de sécurité et d’efficacité (article L5121-1 du Code de la Santé Publique). L’obtention de leur AMM repose notamment sur la démonstration de la bioéquivalence avec le médicament princeps.
À la différence d’un médicament biosimilaire, un médicament générique ne nécessite pas de développement en recherche fondamentale (pas d’analyse physicochimique de biosimilarité ni d’études cliniques d’efficacité et de sécurité).

Les autorités européennes ont élaboré des “guidelines” qui précisent les conditions nécessaires à l’obtention d’une AMM pour un médicament biosimilaire. Ils sont homologués selon des conditions strictes afin de garantir la sécurité des patients1.
Plusieurs éléments sont analysés dans le processus de démonstration préclinique et clinique de biosimilarité entre le médicament biosimilaire et le médicament biologique de référence2.
Le premier élément repose sur l’évaluation comparative de la qualité pharmaceutique (analyse des caractéristiques structurales et fonctionnelles).
Le second élément repose sur les données d’efficacité et de sécurité obtenues à partir d’études cliniques comparatives (pharmacodynamie, pharmacocinétique et immunogénicité). Des études de phases III comparant l’efficacité et la tolérance sont également réalisées.
De plus, la mise sur le marché d’un médicament biosimilaire s’accompagne d’un dispositif de surveillance mis en oeuvre par le laboratoire. Ce dispositif doit comporter les mêmes mesures que le médicament biologique de référence, mais aussi une surveillance de la réponse immunologique lors de l’administration du produit1.
Dans le cas des facteurs de croissance des lignées blanches, des douleurs osseuses et des hyperleucocytoses peuvent survenir, quel que soit le type de G-CSF (médicament de référence ou médicament biosimilaire). La survenue d’un effet ou d’un événement indésirable chez un patient traité par un médicament biosimilaire peut donc être rapportée à l’effet de classe thérapeutique.
L’ensemble des données de tolérance issues des essais cliniques montrent une équivalence des profils de tolérance entre le médicament biosimilaire et le médicament de référence. Il est important de poursuivre ce développement par des études de phase IV afin de suivre et d’évaluer, dans les conditions réelles d’utilisation et avec plus de recul, l’impact “en vie réelle” de l’utilisation des médicaments biosimilaires.
Ces études peuvent être mises en place, après la commercialisation du médicament, dans le cadre de la pharmacovigilance. Ces essais sont encadrés par les agences de santé.
Les médicaments biosimilaires sont des médicaments biologiques développés pour être similaires à des médicaments biologiques déjà existants, dits de référence, commercialisés et utilisés depuis plus de 10 ans en pratique courante
Les médicaments biosimilaires ne sont pas de nouveaux médicaments au sens propre mais ils suivent un processus de développement rigoureux qui répond aux guidelines européennes strictes exigées par l’EMA. Ces guidelines imposent de fournir au dossier d’AMM des données de bio-équivalence basées sur des études comparatives en termes de qualité, d’efficacité et de sécurité entre le médicament biosimilaire et le médicament de référence1.
Ces données comparatives d’efficacité et de tolérance amenant à la biosimilarité des deux médicaments assurent leur utilisation en toute sécurité.
Comme pour l’ensemble des médicaments innovants, les médicaments biosimilaires sont autorisés selon des conditions strictes afin de garantir la sécurité des patients. Si le médicament biosimilaire obtient de l’EMA un avis favorable à l’octroi d’une AMM (profil de qualité, efficacité et sécurité comparable à celui du médicament de référence), les bénéfices du médicament sont alors supérieurs à ses risques (rapport bénéfice/risque favorable) et le médicament peut donc être utilisé en toute sécurité.
Références :
1. Rapport ANSM. Etat des lieux sur les médicaments biosimilaires. Mai 2016
Au cours des procédés de production des médicaments biosimilaires, les substances actives biologiques doivent conserver leurs propriétés biologiques afin de pouvoir assurer leurs activités thérapeutiques dans l’organisme sans induire de réactions d’intolérance liées à la présence d’impuretés ou de produits de dégradation1. Le respect des procédures BPF (Bonnes Pratiques de Fabrication) par les industriels assure la qualité de la fabrication des médicaments biologiques.
Les études comparatives de tolérance entre le médicament biologique de référence et le médicament biosimilaire montrent une immunogénicité comparable. De plus, un dispositif de surveillance en terme de sécurité est mis en place après la commercialisation des médicaments biosimilaires afin de surveiller le profil immunologique du produit biosimilaire.
Les médicaments biosimilaires, comme les médicaments de référence, peuvent présenter un risque de réaction immunoallergique. Ces risques sont notamment encadrés et limités par la mise en place d’études de tolérance et d’études observationnelles post-AMM qui assurent une surveillance étroite. Comme tout médicament, un biosimilaire fait l’objet d’un suivi continu et chaque laboratoire est tenu de mettre en place un système de surveillance des effets indésirables signalés par les professionnels comme par les patients eux-mêmes1.
La réponse est désormais vraie mais uniquement pour certains groupes.
Le projet de loi de finance la sécurité sociale pour 2022 a introduit la possibilité de substituer des médicaments biologiques par le pharmacien selon certaines conditions ; les deux premiers groupes de biosimilaires substituables ont été publiés par arrêté ministériel du 12 avril 2022 (JO du 14 avril 2022), suivant avis de l’ANSM ; Il s’agit du fligrastim et du pegfilgrastim.
Les médicaments biologiques, de référence ou biosimilaires, ont une part de variabilité intrinsèque liée à la source biologique et à leur complexité structurale. La composition d’un médicament biologique peut varier à la suite de diverses modifications telles que le changement de site industriel ou à la suite de l’optimisation des milieux de culture cellulaire.
En effet, la voie de synthèse à partir d’un système biologique entraîne des formes variantes. La complexité des molécules, de haut poids moléculaire, impacte également sur cette variabilité1.
Pour conclure, les médicaments biologiques, qu’ils soient biosimilaires ou de référence, ne sont pas des produits parfaitement homogènes. Toutefois, cette variabilité n’influe pas sur la qualité, l’efficacité et la tolérance du médicament biosimilaire en comparaison au médicament de référence.
Les indications du médicament biologique de référence ne sont pas obligatoirement toutes étudiées au cours des études cliniques de comparabilité réalisées avec le médicament biosimilaire1, et le principe de l’extrapolation peut s’appliquer.
Le principe d’extrapolation des données cliniques d’efficacité et de sécurité aux autres indications est régi par les guidelines de l’agence européenne du médicament (EMA). Il est basé sur les résultats des études de comparabilité en termes de qualité, d’efficacité et de sécurité, et doit être pleinement justifié par des données scientifiques adéquates et solides prenant en compte les caractéristiques du produit ainsi que la pathologie (mécanisme d’action, récepteurs impliqués dans les indications concernées).
L’extrapolation s’applique aux médicaments biosimilaires après évaluation de l’EMA et dès lors que les données de développement clinique ont montré des résultats robustes d’efficacité et de sécurité dans l’indication la plus représentative (sensible) du médicament biologique de référence.
Les étapes de recherche et de fabrication durent près de 10 ans. Des études de comparaison par rapport au biomédicament de référence doivent être effectuées par les laboratoires pharmaceutiques. Pour être commercialisé, le biosimilaire est évalué de manière très stricte par l’Agence Européenne du Médicament (EMA). Leur efficacité et leur sécurité sont donc démontrées et sont similaires à leur médicament de référence. Vous serez donc traité de la même manière qu’avec le médicament de référence et avec le même résultat.
Figure 2: Processus de développement des médicaments biosimilaires. PK = pharmacocinétique ; PD = pharmacodynamique.
Le développement pré-clinique avec l’analyse structurale et fonctionnelle, et clinique des médicaments biosimilaires s’appuie sur la démonstration d’une efficacité et d’une tolérance comparable entre le médicament biosimilaire et le médicament biologique de référence1.
À travers le développement pré-clinique, il s’agit de démontrer une faible variabilité entre la molécule originale et la molécule biosimilaire, sur le plan structural et fonctionnel. Le développement clinique reste spécifique et consiste à s’assurer, une fois la similarité établie, de l’équivalence du rapport efficacité/tolérance en comparaison au médicament de référence. Les effets thérapeutiques à long terme sont identifiés à partir de la pharmacovigilance. Les agences sanitaires considèrent que les effets thérapeutiques du médicament biosimilaire sont similaires à ceux du médicament de référence qui est utilisé depuis de nombreuses années et pour lequel les effets thérapeutiques sont connus.
La rigueur de l’agence européenne qui impose une évaluation de la tolérance et de l’efficacité des médicaments biosimilaires suivant le processus de développement recommandé va donc dans le sens d’une efficacité similaire avec le médicament biologique de référence. Par ailleurs, les dispositifs de surveillance imposés et mis en place par les industriels après la mise sur le marché permettent d’assurer le suivi de l’efficacité et de la sécurité des médicaments biosimilaires.
Un médicament biosimilaire est similaire à un médicament biologique de référence dont le brevet est tombé dans le domaine public1. Le développement en recherche fondamentale des médicaments biosimilaires est donc moins lourd que celui des médicaments biologiques de référence ; le coût de production est ainsi moins élevé.
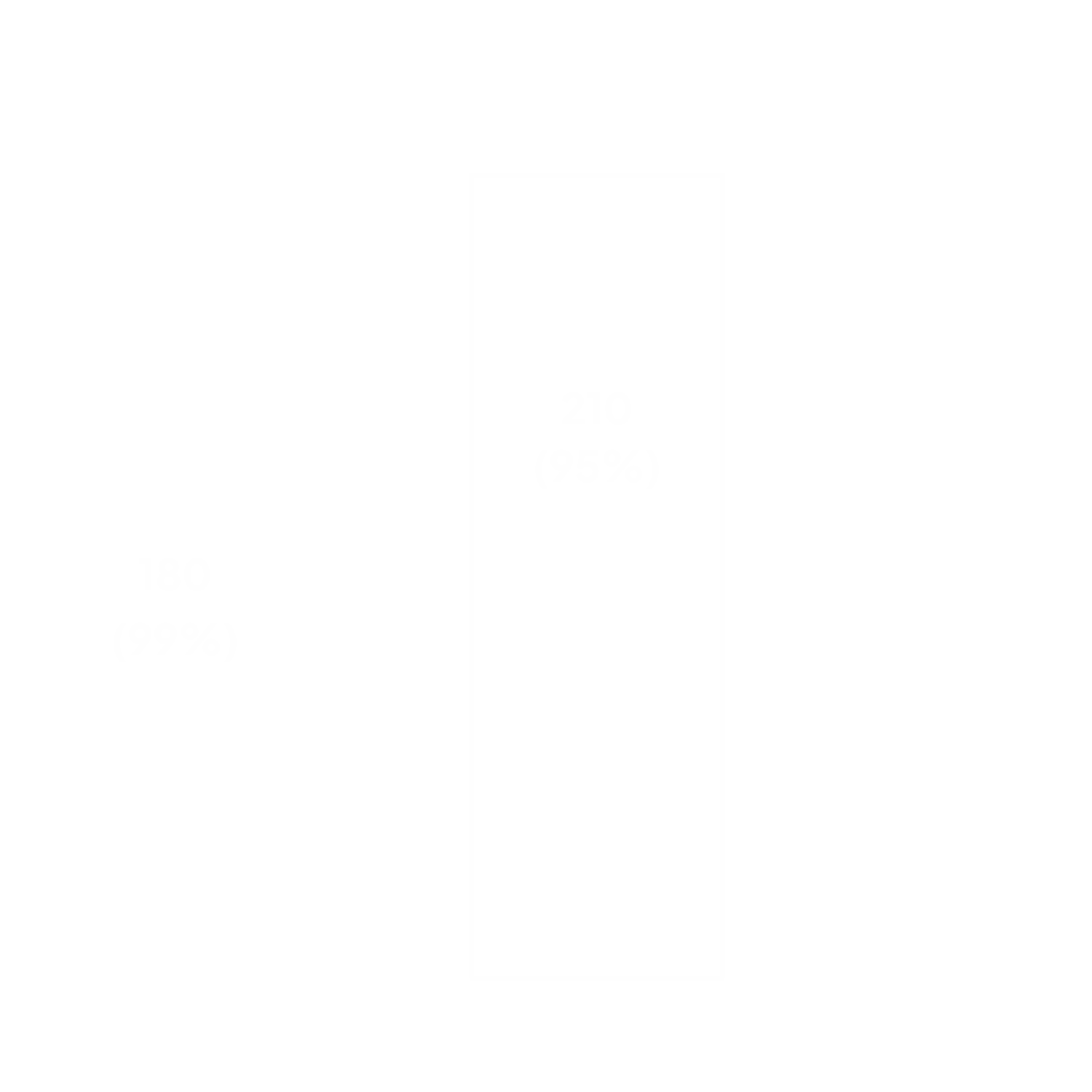
Le prix d’un médicament biosimilaire est diminué de 20 à 30 % par rapport au prix du médicament biologique de référence2.
Cette différence de prix entre un médicament biosimilaire et le médicament biologique de référence peut générer des économies considérables pour l’assurance maladie, d’autant plus si les volumes de prescriptions des médicaments biosimilaires sont importants.
L’Agence Européenne du Médicament (EMA) définit des guidelines pour l’ensemble des pays européens. La législation européenne a par exemple adopté plusieurs textes communautaires statuant sur les médicaments à usage humain en 2003 et 2005, et un groupe de travail de l’EMA a élaboré des recommandations pour le développement des médicaments biologiques humains en 20031-3.
En respectant bien évidemment les recommandations européennes, chaque pays est en mesure d’établir son propre cadre réglementaire. En France, la réglementation est la même que celle définit par l’EMA, à l’exception du point concernant la substitution (par le pharmacien) et l’interchangeabilité (par le médecin) qui est défini dans la loi de financement de la sécurité sociale pour 2017 (voir question 6) mais non encadré par un décret d’application4.
Dans le monde, il est possible que certains pays ne suivent pas les recommandations des agences internationales de la santé. C’est par exemple le cas de certains pays plus défavorisés économiquement qui considèrent que ces recommandations sont trop rigoureuses et inadaptées à leur pays. Ces pays décident alors de suivre les recommandations de l’OMS ou bien de créer leurs propres règles comme le font certains pays d’Amérique Latine.
La rigueur de l’agence européenne qui impose une évaluation de la tolérance et de l’efficacité des médicaments biosimilaires suivant le processus de développement recommandé va donc dans le sens d’une efficacité similaire avec le médicament biologique de référence. Par ailleurs, les dispositifs de surveillance imposés et mis en place par les industriels après la mise sur le marché permettent d’assurer le suivi de l’efficacité et de la sécurité des médicaments biosimilaires.
L’objectif du développement des médicaments biosimilaires est de permettre une réduction des coûts liés à des molécules onéreuses dont les brevets sont tombés dans le domaine public. En mettant en concurrence différentes sociétés commercialisant des molécules biologiques, l’idée est de favoriser une réduction globale des coûts par molécule (médicament biosimilaire versus médicament biologique de référence)1.
L’entrée de nouveaux acteurs sur le marché des médicaments biosimilaires pourrait être un moteur de développement d’études cliniques de phase IV (suivi en vie réelle)1.
Par ailleurs, les laboratoires qui commercialisent les molécules biologiques de référence seront stimulés afin d’investir et de découvrir de nouvelles molécules innovantes pour faire face à la réduction de leur chiffre d’affaires dû à ces molécules anciennes. Ces laboratoires ont tendance à développer de nouvelles formulations et/ou à élargir l’AMM de leur spécialité à de nouvelles indications pour garantir la continuité des marchés.
En réduisant les dépenses de santé liées au remboursement de ces molécules, l’objectif est de favoriser la recherche fondamentale en vue découvrir de nouveaux traitements innovants. C’est ce qu’on peut voir actuellement avec le développement des immunothérapies2.
Il existe actuellement plusieurs catégories de médicaments biosimilaires1 :
Les principaux médicaments développés à ce jour sont ceux dont le brevet est tombé (ou le seront bientôt) dans le domaine public2,3.
Le marché est donc encore limité, il représentait en 2010 15 % du marché pharmaceutique mondial et devait dépasser 20 % en 2015 avec 200 milliards de dollars 2,3. Comme le montre la figure 4, les prévisions des ventes des produits issus de la biotechnologie augmentent, que ce soient les médicaments biologiques de référence ou les médicaments biosimilaires. La part de ces derniers devrait prendre de l’importance dans les années à venir avec la chute des brevets de plusieurs molécules biologiques très largement prescrites2.
En France, le marché est beaucoup plus ouvert et représente 40 % du marché hospitalier et 25 % du marché pharmaceutique total avec une croissance de 3 à 4 % annuels. Les ventes ont atteint 80 millions d’euros en 2014³.
Le biosimilaire se présente sous la même forme que son médicament de référence. Il est administré de la même façon, à la même dose et à la même fréquence. Et pour le médecin, rien ne change : votre suivi sera effectué de la même manière.