Q9
RÉPONSE
Les biosimilaires sont aussi efficaces et sans danger.
- Les étapes de recherche et de fabrication durent près de 10 ans. Des études de comparaison par rapport au biomédicament de référence doivent être effectuées par les laboratoires pharmaceutiques. Pour être commercialisé, le biosimilaire est évalué de manière très stricte par l’Agence Européenne du Médicament (EMA). Leur efficacité et leur sécurité sont donc démontrées et sont similaires à leur médicament de référence. Vous serez donc traité de la même manière qu’avec le médicament de référence et avec le même résultat.
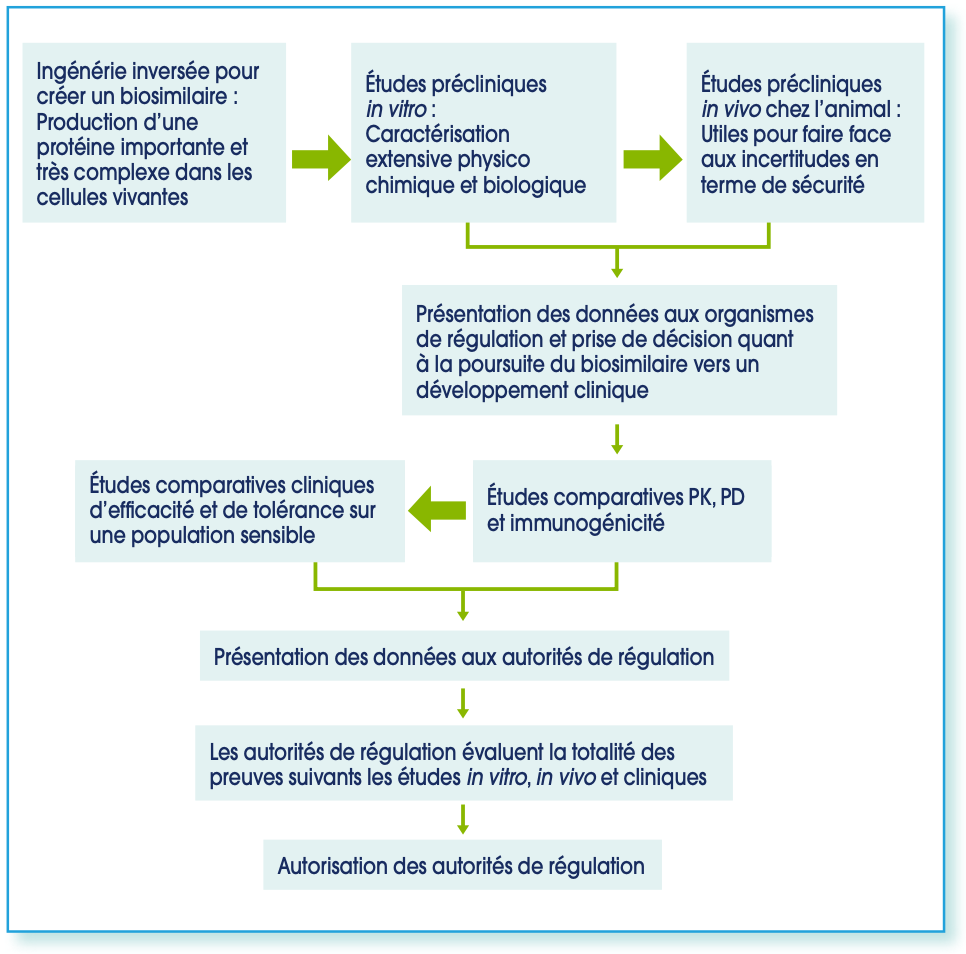
Figure 2: Processus de développement des médicaments biosimilaires. PK = pharmacocinétique ; PD = pharmacodynamique.
- Le développement pré-clinique avec l’analyse structurale et fonctionnelle, et clinique des médicaments biosimilaires s’appuie sur la démonstration d’une efficacité et d’une tolérance comparable entre le médicament biosimilaire et le médicament biologique de référence1.
- À travers le développement pré-clinique, il s’agit de démontrer une faible variabilité entre la molécule originale et la molécule biosimilaire, sur le plan structural et fonctionnel. Le développement clinique reste spécifique et consiste à s’assurer, une fois la similarité établie, de l’équivalence du rapport efficacité/tolérance en comparaison au médicament de référence. Les effets thérapeutiques à long terme sont identifiés à partir de la pharmacovigilance. Les agences sanitaires considèrent que les effets thérapeutiques du médicament biosimilaire sont similaires à ceux du médicament de référence qui est utilisé depuis de nombreuses années et pour lequel les effets thérapeutiques sont connus.
- La rigueur de l’agence européenne qui impose une évaluation de la tolérance et de l’efficacité des médicaments biosimilaires suivant le processus de développement recommandé va donc dans le sens d’une efficacité similaire avec le médicament biologique de référence. Par ailleurs, les dispositifs de surveillance imposés et mis en place par les industriels après la mise sur le marché permettent d’assurer le suivi de l’efficacité et de la sécurité des médicaments biosimilaires.
Référence
1. Rugo HS et al. A clinician’s guide to biosimilars in oncology. Cancer Treatment Reviews 2016; 46:73-9